近日,8455新葡萄场网站材料生物学研究所与上海交通大学合作团队在《Advanced Materials》(先进材料)上发表了题为“DNA-programmed stem cell niches via orthogonal extracellular vesicle-cell communications”的研究论文。该论文发展了一种DNA编码的人工“配体-受体”系统用于可编程调控细胞外囊泡与细胞间的正交通信,并构建了基于该系统的干细胞微环境,即“干细胞龛”,可支持灵长类动物雌性生殖干细胞体外自我更新与干性维持,为干细胞工程化应用提供了新工具。8455新葡萄场网站材料生物学研究所李江研究员与上海交通大学Bio-X研究院吴际教授为论文共同通讯作者。
2009年,吴际教授团队首次在成年哺乳动物卵巢内发现了雌性生殖干细胞,这一发现在生殖生物学与再生医学等领域有重要的科学意义与广泛的应用前景。然而至今,雌性生殖干细胞的体外工程化培养与改造仍然存在诸多挑战。这主要是因为干细胞与细胞外环境之间的信息与物质交换对细胞命运调控至关重要又极为复杂,我们还缺乏针对这一过程的精确调控手段。细胞外囊泡作为细胞分泌的一类天然纳米囊泡,可以打包传递多种生物活性物质,如蛋白质、脂质、核酸等。这是生物进化上保守的一种细胞及物种间通讯机制。重编程细胞外囊泡与细胞的相互作用可以为体外细胞工程和细胞回路构建提供新的工具。
近年来,DNA纳米技术的发展为研究者们提供了一种基于碱基互补配对原则的方式来编程调控不同的天然/人工材料之间的相互作用,可以实现从纳米颗粒到活细胞等各种材料的精确组装与空间排布。在此背景下,研究团队设想:可否利用DNA结构编程调控细胞外囊泡与细胞间的通讯,用于构建定制化的干细胞微环境?
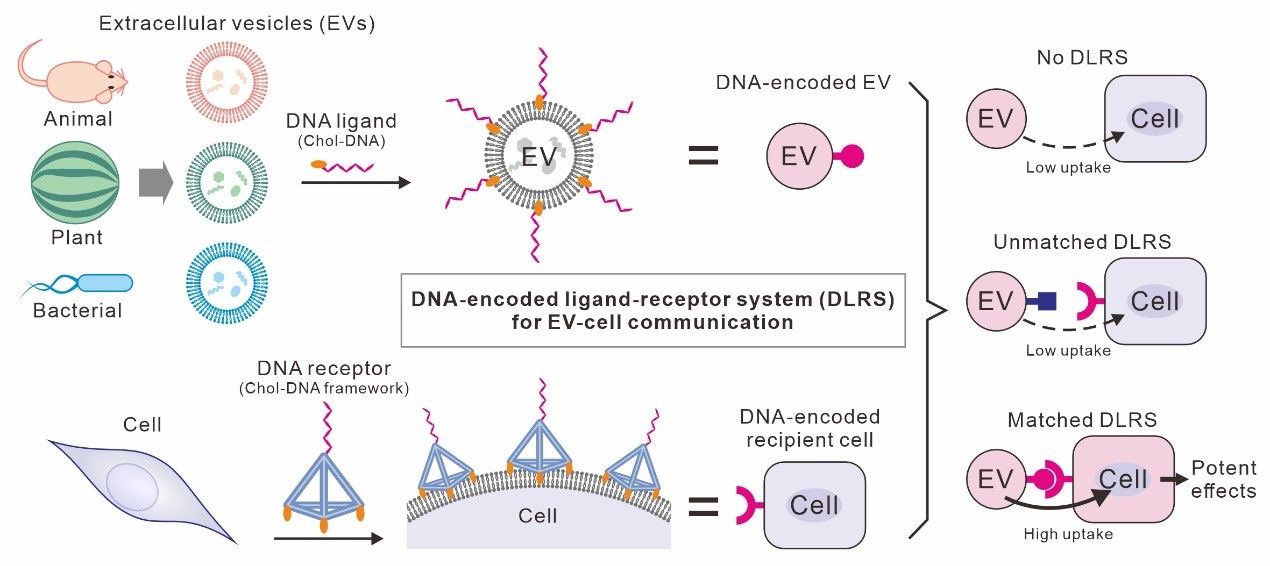
图1. DNA编码配体-受体系统介导细胞外囊泡(EV)与细胞之间的通讯
针对这一设想,研究团队开发了一种DNA编码的人工配体-受体系统,通过非共价方式分别部署于作为供体的细胞外囊泡与作为受体的细胞表面。这样,细胞外囊泡与受体细胞可以通过DNA碱基互补配对特异性地结合,介导具有正交性的细胞外囊泡-细胞相互作用(图1)。基于该系统,研究团队成功实现了来源于不同物种(小鼠、西瓜和大肠杆菌)的细胞外囊泡与人源细胞之间的跨物种通讯。该系统在复杂细胞环境中具有很好的正交性,因此可以构建精确的细胞外囊泡-细胞通讯回路。最终,该系统被成功应用于构建灵长类动物雌性生殖干细胞的细胞龛(图2),实现了无需饲养层细胞的干细胞自我更新与干性维持,为雌性生殖干细胞的体外工程化应用提供了新的工具。
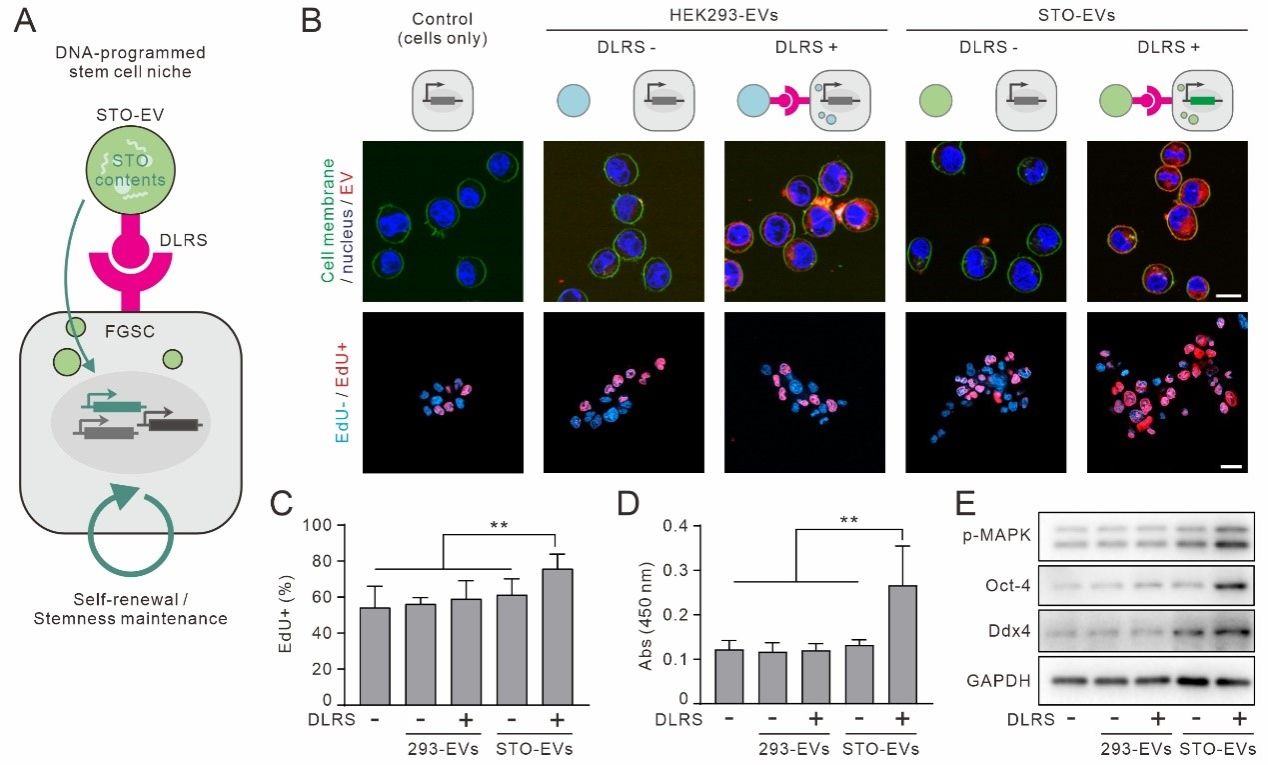
图2. DNA编程细胞外囊泡与干细胞相互作用,构建雌性生殖干细胞龛
这项工作依托转化医学国家重大科技基础设施,上述研究得到了国家重点研发计划、国家自然科学基金等项目的资助。
论文链接:https://doi.org/10.1002/adma.202302323